Hágase la luz
La luz… Una dualidad onda/corpúsculo que lleva con nosotros desde el comienzo de los tiempos… Y que también sirve, como no, para realizar análisis en Proteómica.
Así a bote pronto se me ha ocurrido explicaros 3 aplicaciones cotidianas en todo laboratorio de Proteomica que se precie que usan la luz como método de análisis o como parte de un análisis.
La primera de estas técnicas es una de las mas citadas por todos los artículos proteómicos: la técnica de Bradford.
Esta técnica sirve para medir la cantidad de proteína presente en una muestra. Sí, lo se, lo se, hay mas métodos (por ejemplo, el método de Lowry) pero al fin y al cabo todos basan su medida final en el resultado que de un espectrofotómetro que va a medir la variación de Absorbancia de luz de una muestra.
En un ensayo de proteínas de Bradford se emplea un colorante hidrofóbico en una mezcla de agua y de ácido fosfórico. Esta mezcla tiene un color pardo-rojizo y suele comprarse en forma de preparado comercial.
La disolución del colorante al entrar en contacto con el interior de una proteína, vira su color de pardo-rojizo a azul. Este cambio de color se puede medir mediante el uso de un espectrofotómetro cuya fuente de emisión de luz se encuentre a 595nm (espectro visible).
Este método de medida de cantidad de proteína depende de la interacción entre este colorante hidrofóbico y las proteínas y es muy sensible a la presencia de contaminantes (detergentes, orgánicos…) por lo que hay que tener en cuenta como se ha preparado la extracción de proteínas que vamos a medir. Además tiene un rango lineal bajo, por lo que es necesario realizar disoluciones en muchas ocasiones para que la medida quede dentro del rango de medición.
Para superar estas limitaciones existen varias alternativas también basadas en las medidas mediante espectrofotometría y que suelen adquirirse bien preparadas o bien se fabrican de forma «casera» en el laboratorio siguiendo protocolos establecidos a tal efecto.
La principal ventaja del método de Bradford es que es muy fácil de llevar a cabo y muy rápido (a mi no me lleva más de 10-15 minutos) y cosa que no puedo decir de otros métodos alternativos que se me hacen largos y tediosos.
La segunda de las técnicas es la adquisición de imágenes a través de un escáner láser. Así es, podemos iluminar de forma un gel como los de la anterior entrada o cualquier otro teñido con un fluoróforo (Sypro, ProQ Diamond, etc), punto por punto y a la longitud de onda justa para que sólo ese fluoróforo se excite y nos emita luz y obtener una imagen con una calidad excepcional.
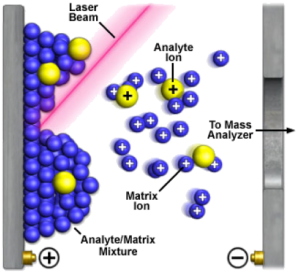
Por ultimo y no menos importante, la aplicación de la luz para iniciar el análisis de la secuencia de péptidos e identificación de proteínas. Para esto también utilizamos láser y en concreto lo hacemos para excitar una serie de moléculas de una sustancia que contiene nuestros péptidos. Es lo que se conoce como fuente de ionización Maldi.
La desorción de iones asistida por láser (MALDI: Matrix-assisted laser desorption ionization) es uno de los dos métodos de ionización “suaves” que actualmente se utilizan en espectrometría de masas. Fue desarrollado por Karas y Hillenkamp a finales de los 80.
Las muestras son coprecipitadas en un soporte metálico con una matriz, es decir, una sustancia usada para inmovilizar la muestra y que permitirá ionizar la muestra. Esta matriz suele ser ácido alfa-ciano-4-hidroxicinnámico, ácido sinapínico o ácido 2,5-dihidroxibenzoico.
Pues bien, el sólido resultante (recordad, mezcla de matriz y nuestros analitos) depositado sobre ese soporte se irradia con pulsos de láser con longitudes de onda en el infrarrojo o ultravioleta (normalmente láseres de N2 que emiten a 337 nm).
Para que os hagáis una idea, esto es lo que ocurre:
El láser provoca que la matriz se excite y literalmente «salte» del soporte, ionizándose de camino junto con nuestros péptidos, que es lo que nos interesa analizar , entrando en la segunda fase de un espectrómetro de masas, el analizador (tipo TOF, cuadrupolo, etc).
Pero la historia de los componentes y tipos de espectrómetros de masas os lo dejo para otro día…
Este Post participa en la VII edición del Carnaval de Biología, albergado por Manuel Sánchez en su blog Curiosidades de la Microbiología
Publicado el 14 noviembre, 2011 en Básico, Técnicas. Añade a favoritos el enlace permanente. 11 comentarios.





Nosotros en 2º de Bioquímica hemos utilizado Bradford para medir la cantidad de invertasa en unas muestras y la verdad es que es un método bastante sencillito. Además no sé por qué el espectofotómetro me parece un aparato realmente divertido 😀
Gracias por el comentario Gonzalo! Menudos recuerdos me traes a la cabeza de las practicas con la invertasa!
Un saludo y a seguir disfrutando de esos pobres espectrofotometros de practicas 😉
Hola
Ya he puesto tu entrada en la actualización del carnaval. Disculpa que no la haya visto antes pero el twitter lo veo de vez en cuando.
Un saludo
No te preocupes. Ultimamente andamos todos muy liados con proyectos, oposiciones, obtención de resultados… Yo me encuentro en la misma situación, leo poco el twitter últimamente.
Un saludo!
Debe usted saber que cada vez divulga mejor y que ni se imagina lo que me apasiona el tema de las aplicaciones de la luz en el laboratorio.
Mi técnica preferida?Fluorescencia…La más empleada? Espectrofotometría UV-vis.
Siga usted por este camino de la divulgación que a mí me tiene este blog enganchado.
Un saludo
Jose
Maestro… me halagan tus palabras… La verdad es que le estoy cogiendo a esto el gustillo, creo que conforme se me va quitando el miedo «escénico» voy mejorando un poquito a cada entrada.
A ver si saco tiempo y edito un vídeo donde se explica de forma muy básica los componentes de un espectrómetro de masas. El video lo he grabado durante el curso al que he asistido esta semana, pero no se si el audio se va a poder mejorar.
De todas formas si veo que no puede ser, lo escribiré en forma de resumen.
Me alegro que te tenga enganchado, tu ya llevabas tiempo enganchándome a mi.
Un saludo!
Suscribo el comentario de Jose. El blog comenzó con un buen nivel y ha ido ‘in crescendo’.
Saludos 🙂
Gracias Dani! Es todo un honor viniendo de tí… El primero que hizo un comentario de mi blog y me dio el empujón definitivo para hacerlo!!!
Un saludo
No me dejes tanta responsabilidad, hombre. 😀
Gracias a ti.
Me da memorias de un experimentó en mi curso de química analítica en que investigue los contenidos de gaseosas y pastillas para las migrañas para los niveles de cafeína. También usamos un espectrofotómetro.
Me alegra que te haya gustado el post! Un saludo